Takayanagi Lab.
Research
酸解離メカニズムの理解
○酸解離反応
酸はとても身近な存在であり、化学実験でも触媒などとして頻繁に利用されています。酸の中でも塩酸(HCl)・硫酸(H2SO4)は強酸なので、水分子が周りに存在すると酸解離が起こります。HCl → H+ + Cl-
硫酸の場合は2価の酸なので、2段階の解離が生じます。
H2SO4 → HSO4- + H+ (第1解離)
HSO4- → SO42- + H+ (第2解離)
これらの反応はよく知られており、高校の教科書にも載っている式です。では酸解離反応が起こるためには最低でも何個の水分子が必要でしょうか?また、どういったメカニズムで酸からH+が解離していくのでしょうか?実はこんな基本的な反応であるのに、あまり詳細なことはわかっていません。なぜなら実験で酸が解離する過程などを観測することが出来ないからです。

ミクロな視点からみると… 出典:IPA「教育用画像素材集サイト」
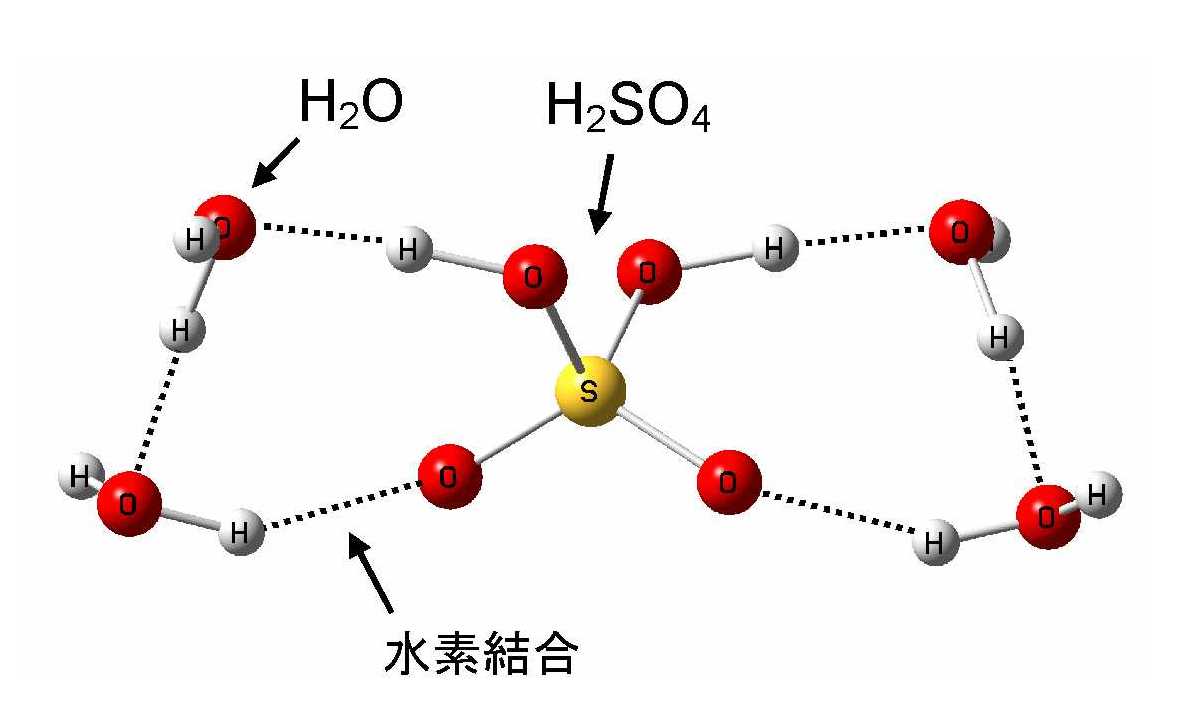
○硫酸・水クラスター
この疑問を解明するため、硫酸に水が数個付いた硫酸・水クラスターを研究対象としました。クラスターとは分子が数〜数十個程度集まった集合体のことで、例えば図1のように硫酸分子1個と水分子4個が互いに弱い力で結びついています。図に載せた以外にも多くの異なった構造が存在します。硫酸・水クラスター(水の数を4から12個)を用いて、室温(約25℃)でのシミュレーションを行いました。
図1 硫酸・水クラスター
○疑問1−水の個数による解離の変化−
第1解離、第2解離は硫酸に何個の水が付くことで起こるのでしょうか?硫酸はH+が解離することによって3つの形態(H2SO4、HSO4-、SO42-)を取ることが出来ます。そこでシミュレーションの結果から、それぞれの形態が何%ずつ存在しているのかを解析してみました。その結果、硫酸に水が4個付いたときではH2SO4が62%、HSO4-が38%存在していることがわかりました。よって水4個では第一解離が起こっていると言えます。 また水10個付いたときはHSO4-が92%、SO42-が8%存在していたため、第二解離が起こっていることがわかりました。 実験での硫酸のpKa値(第2解離)とシミュレーションの結果を比較してみました(pKa値:酸の強さを表すもの pKa=-log10pH)。実験ではpka=2.0(室温程度)であることが知られています。そこで水10個の際のpKa値を求めてみたところ、pka=1.8となり実験値と近い値を与えました。今後水の個数を増やしていけばより実験値に合うかもしれません。○疑問2−解離メカニズム−
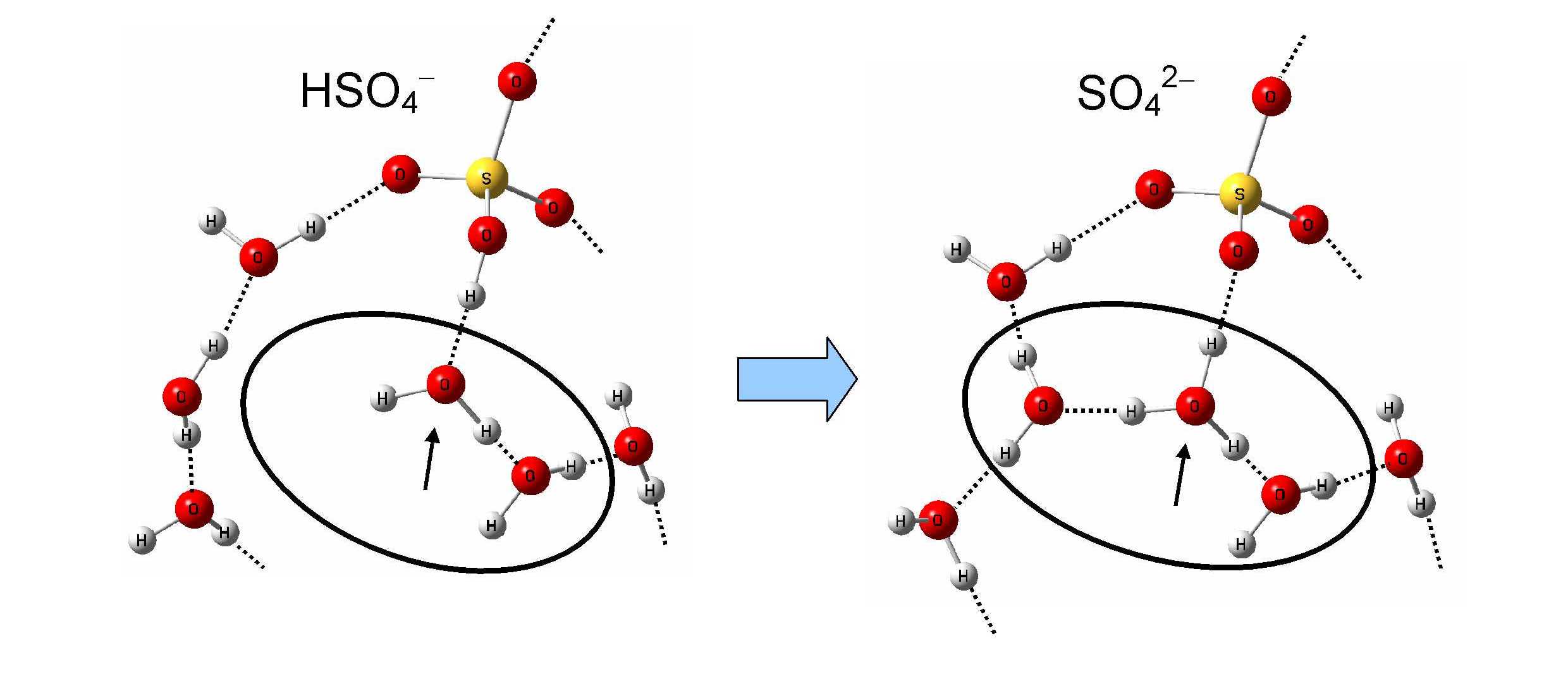
酸解離解離メカニズムについて調べたところ、酸解離には周りの水の構造が大きく影響していることがわかりました。図2に解離メカニズムを図で表しました。左の絵はHSO4-のときの構造、そして右の絵は第二解離した後のSO42-のときの構造です。注目してほしい点は酸から解離したH+を受け取る水分子(矢印)です。実はとてもシンプルなメカニズムで、酸解離は水分子(矢印)に約2個以上の水分子が付くと起こるのです。図2 解離メカニズム
○酸・水クラスター研究
酸・水クラスターは大気化学でも研究されています。例えば雲が生じるときの核生成には硫酸・水クラスターが、また塩酸・水クラスターではオゾン層破壊の初期過程に関わるためです。