Takayanagi Lab.
Research
XeH2の精密な分子軌道計算
◆ 希ガス元素を含んだ化合物
希ガスは、周期表の一番右端18族を占める元素です。希ガス元素には、ヘリウム(He)、ネオン(Ne)、クリプトン(Kr)、アルゴン(Ar)、キセノン(Xe)、そしてラドン(Rn)の6つがあります。高校の化学で習ったと思いますが、これらの希ガス元素は、原子の状態でオクテット則を満たしているため、単原子で安定に存在することが知られています。
しかし、だからといって希ガスが化合物を作らないとは限りません。実際、1962年の Bartrett による Xe+[PtF6]−合成報告をきっかけに、XeF2 などのフッ化物や、XeO2 などの酸化物が合成されました。
このように、希ガスの中でも Xe は化合物を作ることがわかり、これまでさまざまな実験が行われました。こうしたXe化合物のひとつが、XeH2 です。
◆ XeH2 とは何か
XeH2 は Xe を含む化合物の中でもっとも簡単な分子です。この分子は、1995年にフィンランドのRasanen の研究グループによって、報告されました。彼らは、Xe の固体中にうまく Xe と H 原子が混ざった状態を作り出して、その中で生成したXeH2を赤外分光によって同定しています。
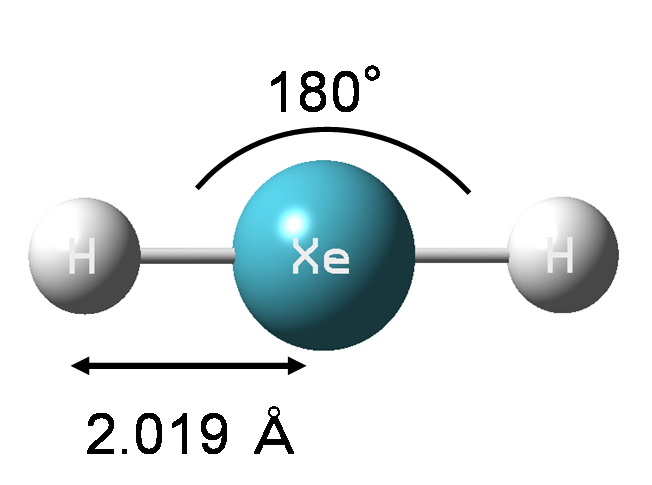
XeH2 は、どのような構造をしているのでしょうか。Rasanenらは分子軌道計算を行って、XeH2 の構造を調べました。その計算によると、XeH2 の安定な構造はXeの両端にHがついた直線型になりました。
XeH2は気体中でも存在するのでしょうか?
Rasanenらの実験では、XeH2 は Xe の固体中にあることから、原子同士が偶然すぐ近くに固定されて結合のように見えてしまっただけかもしれません。
Xe + H2 と XeH2 を比べると、Xe + H2 のほうがはるかに安定であることがわかっています。これは、XeH2が存在したとしても、いつかは Xe と H2 に分解してしまうことを示唆しています。
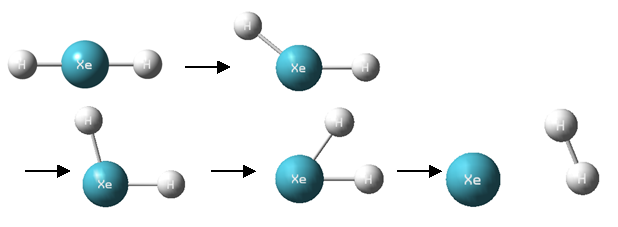
しかし、XeH2 の安定な構造から Xe と H2 に分かれるには、次のように、真ん中にある Xe を端のHが飛び越えるように構造が変化しなくてはいけません。
このような構造変化を起こすには、大きなエネルギーが必要です。そのため、一時的に直線型のXeH2 の形をとると考えられます。
ところがRasanenらの計算では、XeH2よりも Xe + H + H のほうが安定であるという結果になりました。これでは、XeH2 は存在しない分子になってしまいます。
◆ XeH2の何を研究したのか?
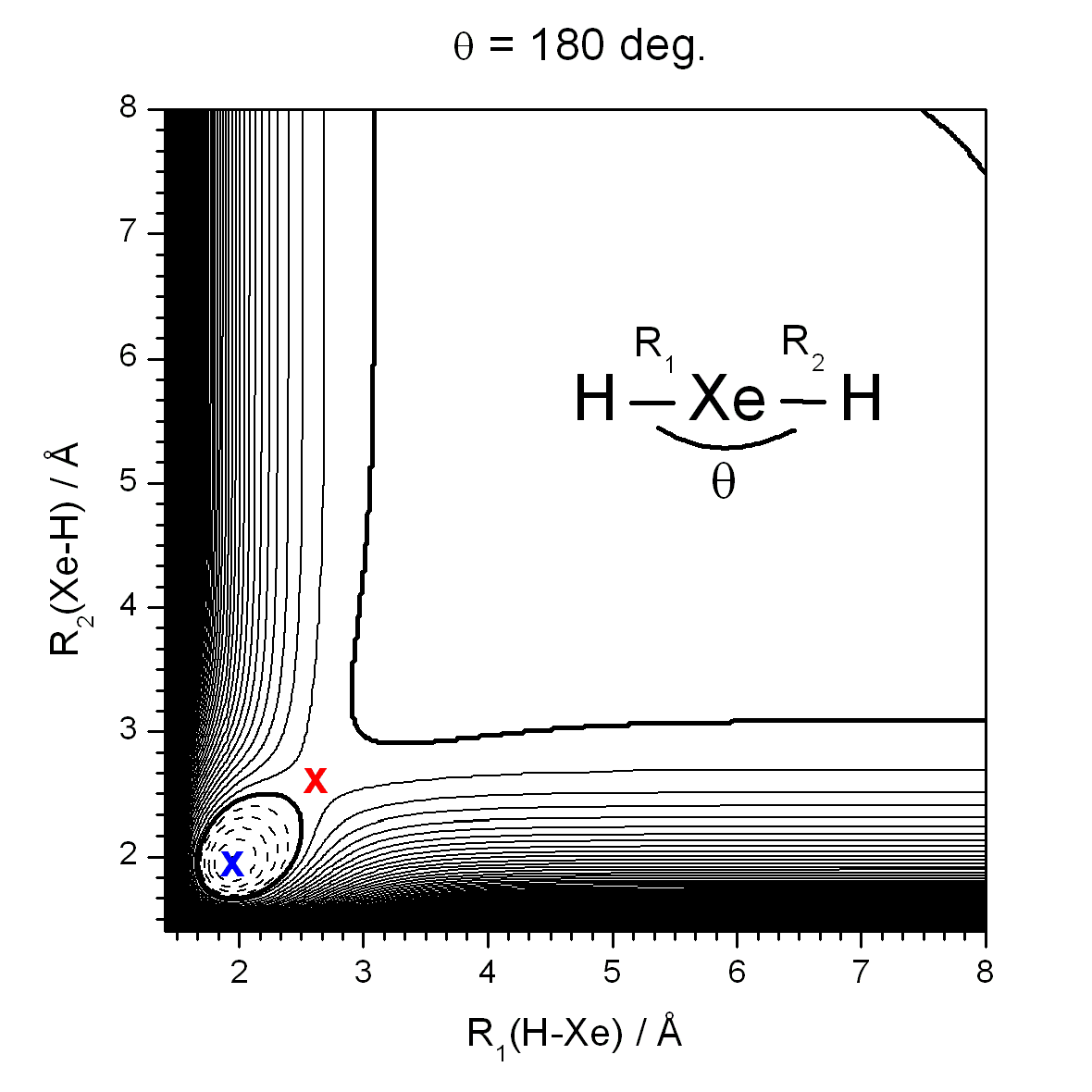
そこで、我々は、XeH2 の安定性を考えるために、重いXe原子の相対論効果も含んだ精密な分子軌道計算を行い、次のようなエネルギーの等高線を得ました。
縦軸と横軸はそれぞれの Xe と H の距離を表しています。図の右上端はXeと2つのH原子に分かれた状態を表しています。
この図から、Xe−Hの長さが1.95 Åのとき(青色のxの点)安定な状態であることがわかりました。また、XeH2 は Xe + H + H の解離レベルより安定であり、XeH2 → Xe + H + H の過程に小さいながらエネルギーの障壁(図の赤いxの点)があることがわかりました。
この結果から、XeH2 は気体中でも十分に存在しうる分子であると考えています。